¿Qué es la terapia celular?
La terapia celular consiste en administrar células vivas a los pacientes para reemplazar o reparar tejidos dañados. La Sociedad Estadounidense de Terapia Génica y Celular (ASGCT) define la terapia celular como “la transferencia de uno o varios tipos específicos de células a una persona para tratar o prevenir una enfermedad”. En la práctica, un médico puede infundir células madre o células inmunitarias (por ejemplo, células madre hematopoyéticas o linfocitos T modificados) en el cuerpo del paciente. Estas células viajan hasta los tejidos dañados, se multiplican y restauran su función. El objetivo es ayudar al organismo a regenerar o curar las células afectadas. En otras palabras, la terapia celular es una forma de medicina regenerativa que busca “desarrollar, reemplazar o reparar tejidos dañados”. Por ejemplo, se han inyectado células madre mesenquimales para tratar articulaciones inflamadas o lesionadas, y se trasplantan células madre sanguíneas para reconstruir la médula ósea tras un tratamiento contra el cáncer.
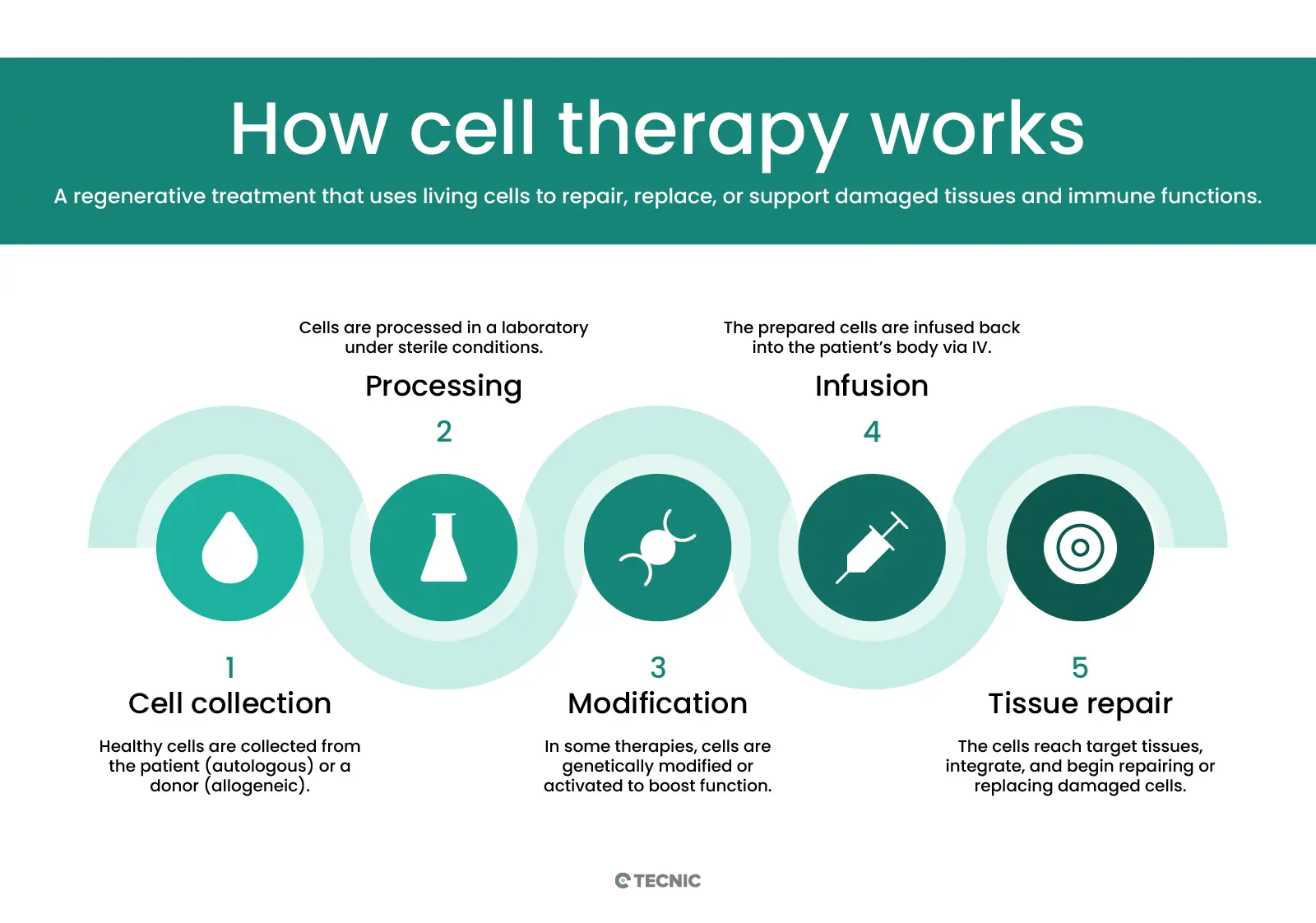
¿Cómo funciona la terapia celular?
La terapia celular funciona mediante la transferencia de células vivas al cuerpo del paciente. Estas células pueden proceder del propio paciente o de un donante. En la terapia autóloga, los médicos extraen células del propio paciente (como células madre de la médula ósea o del tejido adiposo), las modifican o expanden en el laboratorio y luego se las reintroducen. Al tratarse de células propias, el riesgo de rechazo inmunológico se reduce considerablemente. En la terapia alogénica, en cambio, las células provienen de otra persona (un donante compatible).
Por ejemplo, las células madre de la médula ósea de un donante sano pueden administrarse a un paciente que necesita regenerar su sistema sanguíneo. Antes de recibir la infusión de células, los pacientes suelen someterse a un tratamiento de acondicionamiento (quimioterapia o radioterapia) para suprimir el sistema inmunitario o liberar espacio en un tejido, como la médula ósea. Tras la infusión, las nuevas células viajan hasta el órgano objetivo, se implantan (es decir, se integran en el tejido) y comienzan a crecer. A lo largo de semanas o meses, estas células se multiplican y se diferencian en los tipos celulares necesarios. Por ejemplo, las células madre donadas de la médula ósea se dividirán y se convertirán en células sanguíneas sanas, restaurando el sistema hematopoyético del paciente.
¿Qué son las terapias celulares autólogas y alogénicas?
Autólogo y alogénico hacen referencia al origen de las células. La terapia celular autóloga utiliza las propias células del paciente. Los médicos extraen células del paciente (por ejemplo, células madre de la médula ósea), las manipulan si es necesario (añadiendo un gen, por ejemplo), y luego las vuelven a infundir. Al tratarse de células “propias”, el riesgo de rechazo por parte del sistema inmunitario es muy bajo. La terapia celular alogénica utiliza células de un donante. Estas células deben ser cuidadosamente compatibles para evitar una respuesta inmunitaria adversa. Los productos alogénicos suelen ser terapias “listas para usar” (off-the-shelf), ya que pueden prepararse con antelación y administrarse cuando se necesiten. La ASGCT señala que “alo” significa “otro”, lo que subraya su origen donante. En la práctica, muchos trasplantes de células madre (como los usados para tratar la leucemia) son alogénicos: la médula ósea sana de un donante proporciona nuevas células formadoras de sangre. Las terapias CAR-T (para el cáncer) suelen ser autólogas: se recolectan los linfocitos T del propio paciente, se modifican para atacar las células cancerosas y luego se reintroducen en el organismo.
¿Qué enfermedades puede tratar la terapia celular?
Actualmente, la mayoría de las terapias celulares aprobadas están dirigidas a trastornos de la sangre y del sistema inmunitario. Por ejemplo, los trasplantes de células madre hematopoyéticas (formadoras de sangre) son una terapia estándar para la leucemia, el linfoma, el mieloma múltiple y otros tipos de cáncer de médula ósea. Las terapias con células CAR-T (linfocitos T modificados genéticamente) pueden inducir remisiones en ciertos cánceres hematológicos, como la leucemia linfoblástica aguda o el linfoma. Más allá del cáncer, los trasplantes de células madre también se utilizan para tratar síndromes de inmunodeficiencia y trastornos genéticos de la sangre, como la talasemia.
La investigación se está expandiendo hacia muchas otras enfermedades. Dado que las células madre pueden transformarse en distintos tipos de tejidos, los científicos están probando terapias celulares para tratar enfermedades cardíacas, lesiones de médula espinal, diabetes y daños en las articulaciones (como el cartílago). Por ejemplo, en ensayos clínicos pequeños se han inyectado células madre cardíacas tras un infarto para ayudar a regenerar el músculo, o se han trasplantado células derivadas de células madre que forman los islotes pancreáticos para tratar la diabetes. Los primeros estudios muestran resultados prometedores: algunas compañías afirman que las células madre pueden dirigirse para “regenerar y reparar tejidos que han sido dañados o afectados por una enfermedad”. Las personas que podrían beneficiarse incluyen pacientes con enfermedades degenerativas como el Parkinson, la esclerosis lateral amiotrófica (ELA) y la artrosis. En todos los casos, el objetivo es reemplazar las células que no funcionan por células sanas que permitan la recuperación de órganos y tejidos.
¿Cómo regenera tejido la terapia celular?
En la terapia celular, las células inyectadas o infundidas reconstruyen activamente los tejidos dañados. Las células madre tienen la capacidad especial de transformarse en distintos tipos de células. Una vez administradas, se diferencian en las células necesarias e integran en el órgano o tejido afectado. Por ejemplo, una célula madre inyectada en la articulación de la rodilla de un paciente puede convertirse en células de cartílago y contribuir a la reparación de una articulación desgastada. Algunas clínicas explican que los investigadores pueden “generar células sanas para reemplazar las células afectadas por una enfermedad (medicina regenerativa)” utilizando células madre. En estudios con animales, los científicos incluso han reprogramado células de la piel para convertirlas en células del músculo cardíaco, y luego las han inyectado en modelos de insuficiencia cardíaca. Estas nuevas células mejoraron la función cardíaca y aumentaron la supervivencia. En resumen, la terapia celular funciona como un kit de reparación vivo: se entregan millones de células allí donde se necesitan, y estas crecen y producen las proteínas y estructuras necesarias para regenerar el tejido.
¿Cuáles son los riesgos de la terapia celular?
Las terapias celulares pueden tener efectos secundarios graves. Las terapias autólogas (que utilizan células del propio paciente) evitan en gran medida el rechazo, pero las terapias alogénicas (con células de donante) conllevan el riesgo de enfermedad injerto contra huésped (EICH o GVHD, por sus siglas en inglés). En esta afección, las células inmunitarias del donante atacan los tejidos sanos del paciente, lo que puede provocar erupciones cutáneas, daños en el hígado, lesiones en el intestino e incluso poner en riesgo la vida. Los pacientes oncológicos que reciben terapias celulares suelen someterse antes a una inmunosupresión intensa, lo que incrementa el riesgo de infecciones. La ASGCT (Sociedad Estadounidense de Terapia Génica y Celular) advierte que el tratamiento previo con quimioterapia puede “aumentar el riesgo de infecciones… y resultar bastante agresivo para el cuerpo”.
Otro riesgo importante en las terapias basadas en el sistema inmunitario es una reacción inmune descontrolada. Los tratamientos con células CAR-T, por ejemplo, pueden desencadenar el síndrome de liberación de citocinas: una peligrosa “tormenta” de señales inmunológicas. Los síntomas incluyen fiebre alta, presión arterial baja y toxicidad multiorgánica. La ASGCT señala que “demasiadas citocinas pueden provocar fiebre, dificultad para respirar y ser potencialmente mortales”. Los hospitales que administran CAR-T también vigilan posibles toxicidades neurológicas, como confusión o convulsiones.
Es importante destacar que, dado que la terapia celular es un campo relativamente nuevo, aún se están estudiando sus efectos a largo plazo. Los ensayos clínicos incluyen un consentimiento informado riguroso para que los pacientes conozcan los posibles riesgos. Los médicos siguen directrices estrictas para vigilar la aparición de complicaciones. Si surge algún efecto secundario grave, los ensayos pueden interrumpirse temporalmente. En general, aunque muchas terapias celulares han salvado vidas, también pueden desencadenar reacciones inmunitarias o tóxicas graves.
¿Cuánto cuesta la terapia celular?
Las terapias celulares avanzadas son muy costosas. Por ejemplo, los tratamientos con células CAR-T suelen alcanzar varios cientos de miles de dólares por ciclo. Algunos estudios han estimado que el coste médico total de una terapia CAR-T (incluida la hospitalización) ronda entre 450.000 y 500.000 dólares. En pacientes con complicaciones graves, los costes pueden superar los 500.000 dólares. Los trasplantes de células madre de médula ósea (otra forma de terapia celular) también tienen un precio elevado: pueden ir desde decenas de miles hasta más de 200.000 dólares, dependiendo de si se trata de una terapia autóloga o alogénica. Estos precios reflejan la complejidad del proceso (recolección celular, modificación genética, cuidados especializados) y las estancias hospitalarias intensivas que suelen requerirse. Actualmente, las aseguradoras y los sistemas de salud siguen buscando formas de cubrir este tipo de tratamientos.
¿Qué es la terapia génica?
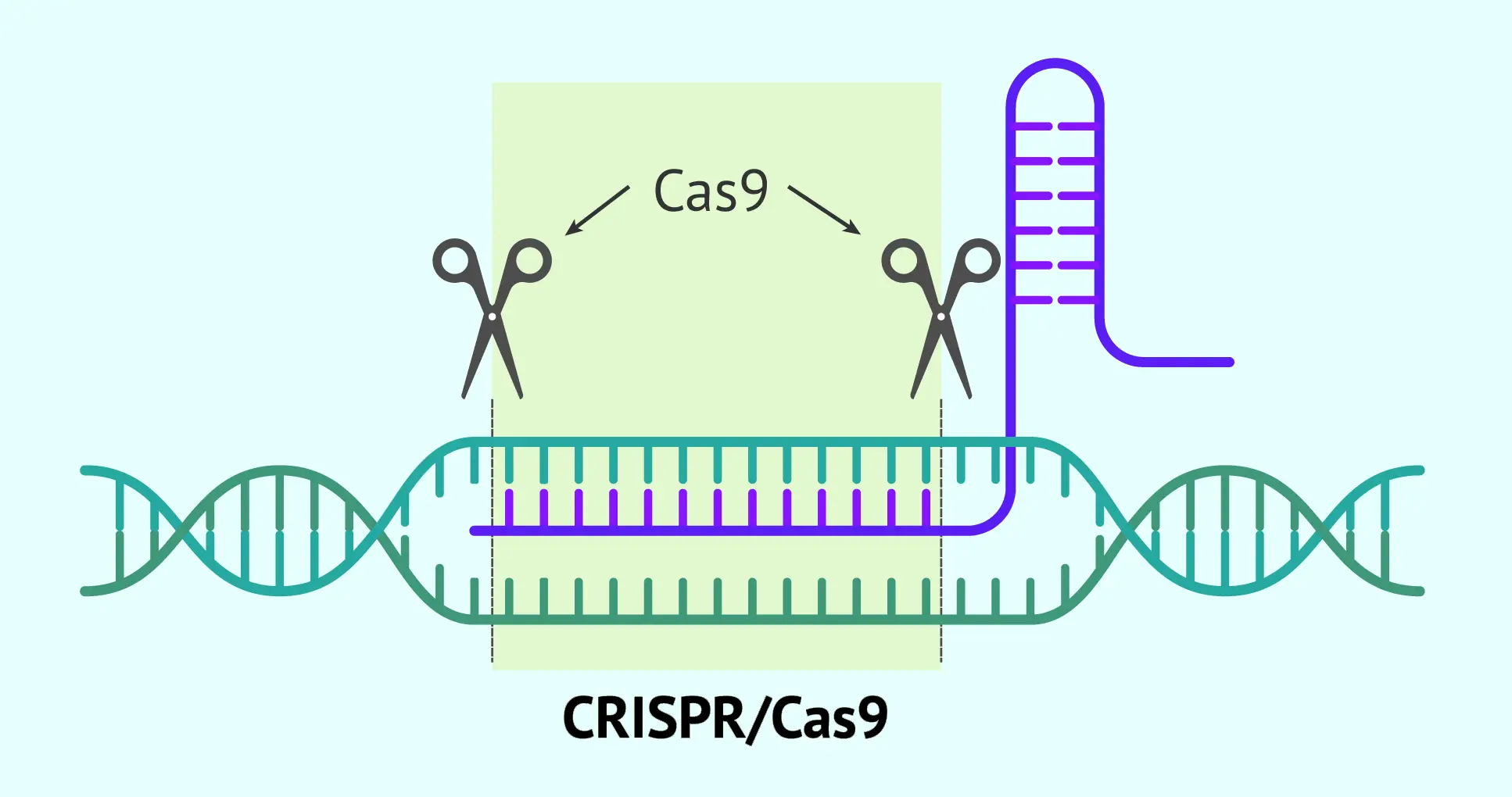
La terapia génica es una técnica que trata enfermedades corrigiendo o manipulando los genes de una persona. La Biblioteca Nacional de Medicina de EE. UU. la define como un “enfoque médico que trata o previene enfermedades corrigiendo el problema genético subyacente”. En la práctica, la terapia génica introduce nuevas instrucciones genéticas en las células del paciente. Por ejemplo, se puede añadir una copia sana de un gen a una persona que tenga una versión defectuosa. Las primeras terapias genéticas (conocidas como adición génica) se centraban en introducir un gen funcional que sustituyera al gen mutado. En cambio, los métodos más recientes emplean edición genética: herramientas moleculares como CRISPR-Cas9 que pueden cortar, reemplazar o desactivar partes específicas del ADN para corregir mutaciones. En todos los casos, el objetivo es modificar el código genético del paciente para que sus células produzcan las proteínas adecuadas.
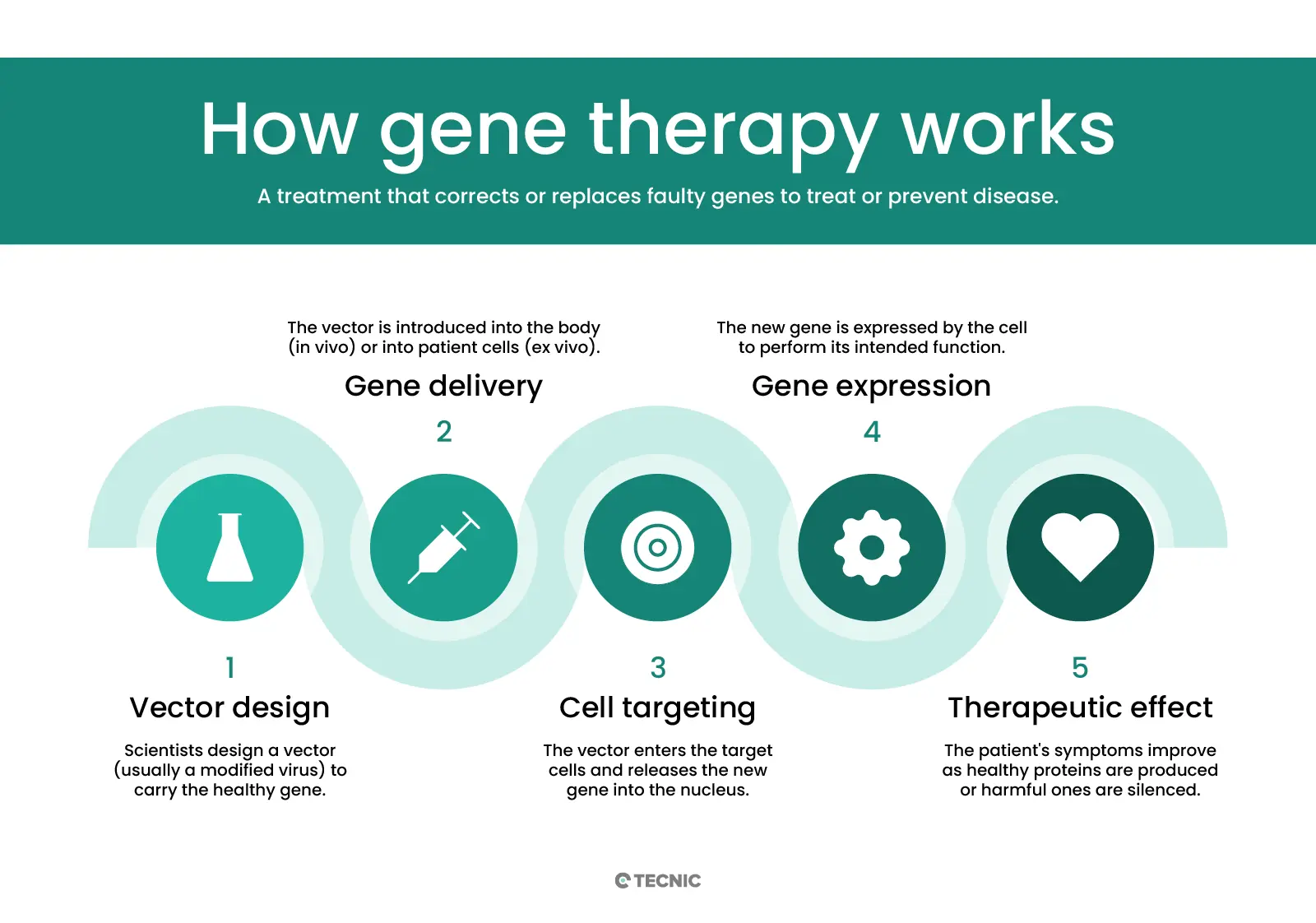
¿Cómo funciona la terapia génica?
La terapia génica introduce material genético en las células mediante un vehículo llamado vector. Un vector funciona como un diminuto camión de reparto: transporta ADN o ARN nuevo hasta las células objetivo. Los vectores virales son los más utilizados, ya que los virus tienen la capacidad natural de inyectar ADN en las células. Los científicos emplean virus inofensivos (como el virus adenoasociado, AAV, o los lentivirus) a los que se les eliminan los genes causantes de enfermedades. La cápside del virus sigue siendo capaz de entrar en las células, por lo que puede llevar de forma segura el gen terapéutico en su interior. Por ejemplo, un vector AAV inyectado en el torrente sanguíneo de un paciente viajará hasta células específicas e insertará el nuevo gen. También se están estudiando métodos no virales, como las nanopartículas lipídicas o la tecnología CRISPR, para evitar las posibles complicaciones asociadas a los virus.
Una vez dentro de la célula, el vector entrega el nuevo gen al núcleo. La célula entonces utiliza ese gen para producir proteínas saludables. En la terapia génica in vivo, este proceso ocurre directamente dentro del cuerpo del paciente: los vectores se administran por infusión intravenosa o mediante una inyección en el órgano objetivo. En la terapia génica ex vivo, los médicos primero extraen algunas células del propio paciente, las modifican en el laboratorio y luego las reintroducen en el organismo. Por ejemplo, se pueden extraer células madre de la médula ósea, insertar un gen funcional mediante un vector viral y después devolverlas al torrente sanguíneo del paciente. Este enfoque es muy similar a la terapia celular: se infunden células vivas al paciente, pero en este caso, esas células ya llevan un nuevo gen incorporado.
¿Cuáles son los tipos de terapia génica?
Las terapias génicas pueden clasificarse según cómo y dónde actúan. En primer lugar, se distingue entre terapia génica somática y terapia génica de la línea germinal. La terapia génica somática afecta únicamente al cuerpo del paciente (cualquier célula excepto óvulos o espermatozoides). Estos cambios no se transmiten a las generaciones futuras. En cambio, la terapia génica de la línea germinal alteraría espermatozoides, óvulos o embriones, de forma que la modificación sería heredable por los hijos del paciente. Este tipo de edición germinal es muy controvertido y actualmente ilegal en la mayoría de países. Por ello, la investigación se centra por ahora en enfoques somáticos.
En segundo lugar, la terapia génica puede ser in vivo o ex vivo, como se describió anteriormente. In vivo significa que el material genético se entrega directamente dentro del cuerpo (por ejemplo, una inyección ocular de un vector viral para una ceguera hereditaria). Ex vivo significa que las células se modifican fuera del cuerpo. Ambos enfoques se utilizan. Por ejemplo, muchas terapias génicas para trastornos sanguíneos usan métodos ex vivo (se editan las células madre sanguíneas del paciente fuera del cuerpo y luego se reintroducen). Los investigadores también distinguen según la tecnología: la terapia génica tradicional añade o reemplaza genes, mientras que la edición génica (como CRISPR) corta o modifica de forma precisa los genes existentes.

¿Qué métodos de entrega se utilizan en la terapia génica?
Los métodos de entrega más comunes en la terapia génica son los vectores virales. Los tres vectores virales más utilizados en terapias aprobadas son el virus adenoasociado (AAV), el lentivirus y el adenovirus. El AAV es popular porque genera reacciones inmunitarias leves y puede entregar genes a muchos tipos de células. El lentivirus (derivado del VIH) se utiliza especialmente en terapias ex vivo, ya que puede insertar genes más largos en células en división. Los investigadores eliminan la mayor parte del ADN viral, conservando solo la "cubierta" y el mecanismo de inserción. Por ejemplo, el AAV se emplea para entregar el gen RPE65 en Luxturna, una terapia génica ocular.
Los métodos no virales también están siendo investigados activamente. Estos incluyen inyecciones de ADN plasmídico, nanopartículas lipídicas y la entrega directa de ARN. También se están explorando métodos físicos, como la electroporación (pulsos eléctricos), y transportadores químicos que permiten introducir genes en las células sin necesidad de utilizar virus.
Una tecnología novedosa destacada es la edición genética con CRISPR-Cas9. En lugar de añadir genes completos, CRISPR actúa como unas “tijeras moleculares” que cortan el ADN en lugares precisos. Los médicos pueden diseñar estas herramientas para eliminar mutaciones que causan enfermedades o para activar/desactivar genes específicos. Las primeras terapias basadas en CRISPR se están probando en ensayos clínicos para enfermedades de la sangre y ciertos tipos de cáncer. Hasta ahora, la mayoría de las terapias aprobadas usan vectores virales para añadir genes, pero CRISPR y otros métodos de edición genética prometen correcciones más precisas en un futuro próximo.
¿Qué enfermedades puede tratar la terapia génica?
La terapia génica es especialmente adecuada para enfermedades genéticas causadas por la mutación de un solo gen. Hasta la fecha, solo un pequeño número de terapias génicas ha sido aprobado por la FDA. Por ejemplo, Luxturna trata una forma hereditaria de ceguera (amaurosis congénita de Leber) al añadir una copia funcional del gen RPE65. Zolgensma está aprobado para la atrofia muscular espinal (una enfermedad mortal en lactantes) y reemplaza el gen ausente SMN1. Hemgenix trata la hemofilia B proporcionando el gen del factor IX de coagulación; su precio ronda los 3,5 millones de dólares por una única infusión.
Otras enfermedades raras que están siendo investigadas en ensayos de terapia génica incluyen la distrofia muscular de Duchenne, la inmunodeficiencia combinada grave, la anemia de células falciformes (mediante células sanguíneas editadas genéticamente), y trastornos metabólicos como la enfermedad de Gaucher o la enfermedad de Fabry. Los investigadores también están explorando la terapia génica para ciertos tipos de cáncer: por ejemplo, introduciendo genes suicidas o genes que potencien la respuesta inmune dentro de los tumores. En resumen, la terapia genética puede dirigirse potencialmente a cualquier enfermedad causada por un gen defectuoso. Hasta ahora se ha utilizado en enfermedades hereditarias del ojo, músculo, sangre y sistema inmunológico, entre otras.
¿Cuáles son los riesgos de la terapia génica?
Dado que la terapia génica implica alterar el ADN, existen importantes preocupaciones de seguridad. Los primeros ensayos de terapia génica (hace más de 30 años) revelaron que introducir genes podía causar reacciones inmunológicas graves o incluso desencadenar cáncer. Por ejemplo, algunos pacientes en un ensayo desarrollaron leucemia después de que la inserción del gen activara otros oncogenes. Estas experiencias enseñaron a los investigadores cómo mejorar la seguridad (mediante el uso de vectores más seguros y un mayor control sobre la inserción del gen).
Los riesgos actuales incluyen respuestas inmunitarias al vector de administración. Aunque los vectores estén “desactivados”, el cuerpo puede reconocerlos como cuerpos extraños. Esto puede provocar inflamación o destruir el vector terapéutico antes de que haga efecto. En casos extremos, una reacción inmunitaria intensa podría poner en peligro la vida (como ocurrió en un ensayo temprano con adenovirus). Otro riesgo son los efectos fuera del objetivo. Si un vector inserta ADN en el lugar equivocado, podría interrumpir otro gen o una región reguladora. Los ensayos modernos vigilan a los pacientes a largo plazo para detectar posibles cánceres tardíos u otros problemas.
La edición genética añade otro nivel de riesgo. CRISPR corta el genoma en sitios específicos, pero a veces puede cortar en secuencias similares (cortes fuera del objetivo). Las ediciones no intencionadas podrían inactivar un gen importante o generar una mutación perjudicial. Por eso, los científicos deben validar cuidadosamente que las ediciones sean precisas.
Por último, existen riesgos éticos y genéticos asociados a las modificaciones en la línea germinal. Alterar el ADN de un embrión fecundado afectaría a todas las células futuras, lo que resulta altamente controvertido y está prohibido por los organismos reguladores. Actualmente, todas las terapias génicas clínicas aprobadas modifican únicamente células somáticas (no producen cambios hereditarios).
Las agencias reguladoras (como la FDA y los NIH) supervisan estrechamente los ensayos clínicos de terapia génica. Exigen un proceso riguroso de ensayos en varias fases (Fase I para evaluar la seguridad, Fase II para la eficacia, etc.). También son obligatorios el consentimiento informado, la revisión por comités de ética independientes y el seguimiento a largo plazo. Aunque ninguna terapia está completamente libre de riesgos, los avances científicos han mejorado considerablemente la seguridad, y actualmente ya hay varias terapias génicas aprobadas para su uso en pacientes.
¿Cuánto cuesta la terapia génica?
Las terapias génicas tienden a ser extremadamente costosas, a menudo tratamientos de una sola vez con precios que alcanzan varios millones de dólares. Por ejemplo, cuando Luxturna fue aprobada en 2017, costaba 425.000 dólares por ojo. La terapia para la atrofia muscular espinal, Zolgensma, cuesta aproximadamente 2,1 millones de dólares por una única infusión. Hemgenix, para la hemofilia B, fue valorada en unos 3,5 millones de dólares, situándose actualmente entre los medicamentos más caros del mundo. Estos altos precios reflejan el complejo proceso de desarrollo y el hecho de que una sola dosis puede proporcionar beneficios duraderos durante años o incluso décadas.
En comparación, los medicamentos tradicionales cuestan mucho menos. Sin embargo, los pacientes con enfermedades genéticas graves a menudo necesitan tratamientos de por vida (infusiones cada pocas semanas), cuyos costes se acumulan con el tiempo. El enfoque de una sola administración de la terapia génica ha llevado a las empresas a establecer precios muy elevados. Las aseguradoras y los sistemas de salud aún están negociando formas de cubrir estos tratamientos “curativos” sin arruinar a los pacientes ni agotar los fondos públicos.
¿Cuál es la diferencia entre la terapia génica y la terapia celular?
A un nivel básico, la terapia génica y la terapia celular son estrategias diferentes. La terapia génica funciona mediante la transferencia de material genético a las células del paciente (a menudo utilizando vectores virales). La terapia celular funciona mediante la transferencia de células vivas en sí mismas al paciente. En la terapia génica, el tratamiento es el nuevo gen o el constructo de edición. En la terapia celular, el tratamiento es la población de células (que pueden haber sido modificadas genéticamente o no).
Existen superposiciones. Por ejemplo, la terapia con células CAR-T es un enfoque híbrido: se extraen las células T del paciente (terapia celular), se modifican genéticamente para portar un gen que combate el cáncer y luego se vuelven a infundir; por eso, a veces se le llama “terapia génica basada en células”. Pero en general, la terapia génica busca corregir el defecto en el ADN, mientras que la terapia celular busca reemplazar o potenciar la función celular.
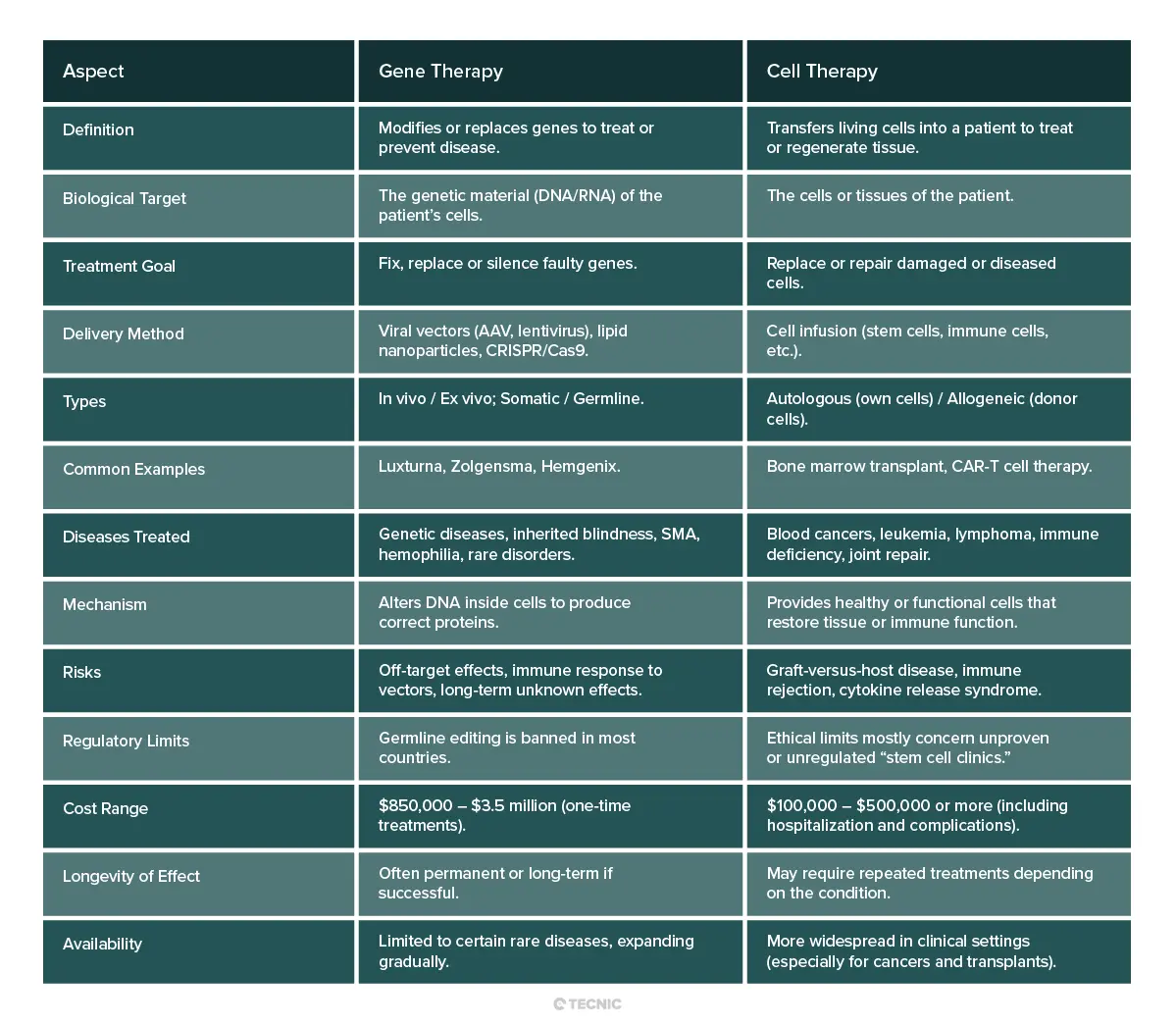
¿Qué es mejor la terapia génica o la terapia celular?
No hay una respuesta simple; depende de la enfermedad y del paciente. Para los trastornos genéticos hereditarios (como la hemofilia, enfermedades de la retina o deficiencias enzimáticas), la terapia génica aborda directamente la causa raíz al añadir un gen correcto. Potencialmente puede curar la afección desde su origen. Para enfermedades causadas por la pérdida o disfunción celular (como la leucemia o el daño en órganos), la terapia celular puede ser más eficaz. Por ejemplo, la leucemia suele tratarse mediante un nuevo sistema inmunitario a través de un trasplante de células madre o células CAR-T, algo que la terapia génica por sí sola no podría lograr.
En algunos casos, ambos enfoques podrían ser efectivos. Para un paciente con un trastorno genético de la sangre, los médicos podrían optar por añadir un gen sano en las células sanguíneas (terapia génica) o realizar un trasplante de células madre (terapia celular). Cuál es “mejor” depende de factores como la tolerancia del paciente al trasplante frente al tratamiento génico, la genética específica de la enfermedad y el coste o la disponibilidad. En resumen, la terapia génica y la terapia celular son herramientas complementarias. Ninguna es inherentemente superior: los médicos eligen la que mejor se adapta al contexto médico.
¿Cuáles son los beneficios y riesgos de la terapia génica frente a la terapia celular?
Beneficios: Ambas terapias ofrecen la promesa de curaciones duraderas, en lugar de limitarse al control de los síntomas. La terapia génica puede corregir un gen defectuoso, restaurando potencialmente la función celular normal de forma permanente. La terapia celular puede regenerar tejidos dañados o potenciar el sistema inmunitario. Por ejemplo, la terapia génica ya ha curado a algunos niños de enfermedades antes mortales (como la inmunodeficiencia combinada grave), y la terapia celular (como las CAR T) ha logrado remisiones en pacientes con cánceres que no respondían a otros tratamientos. Estos enfoques abren posibilidades mucho más allá de lo que pueden lograr los medicamentos tradicionales.
Riesgos: Como se ha comentado, ambas terapias conllevan peligros específicos. Los riesgos de la terapia génica incluyen reacciones inmunitarias al vector y modificaciones no deseadas del ADN. En el caso de la terapia celular, los riesgos incluyen reacciones del injerto y efectos secundarios inflamatorios graves. Los pacientes que reciben cualquiera de estas terapias deben ser controlados de cerca. Además, dado que ambos enfoques son relativamente nuevos, las consecuencias a largo plazo aún no se conocen por completo. Los ensayos clínicos continúan recopilando datos sobre su duración y efectos tardíos.
El costo también representa un factor de riesgo: estas terapias son tan costosas que su acceso puede ser limitado. Esto plantea cuestiones de equidad y asequibilidad. Tal como señala el Instituto Nacional de Salud (NIH), existe la preocupación de si “los altos costos de la terapia genética hacen que solo esté disponible para los más ricos”. En última instancia, los pacientes y sus familias deben sopesar el potencial de una cura frente a los posibles efectos secundarios y las consideraciones financieras y éticas.
¿Qué preocupaciones éticas están asociadas con la terapia génica y la terapia celular?
Surgen varias cuestiones éticas. En el caso de la terapia génica, las principales preocupaciones giran en torno a la alteración genética del plano fundamental del cuerpo humano. La mayoría de los investigadores coinciden en que es ético tratar las células somáticas de un paciente. Sin embargo, la edición de la línea germinal (es decir, realizar cambios hereditarios) es altamente controvertida. Editar un embrión o células reproductivas (espermatozoides/óvulos) podría afectar a generaciones futuras que no pueden dar su consentimiento, y además conlleva riesgos desconocidos. De hecho, la edición génica de la línea germinal está actualmente prohibida en Estados Unidos, Europa y muchos otros países. También existen preocupaciones sobre la “genética de diseño”, es decir, utilizar la terapia génica para mejoras como aumentar la estatura o la inteligencia, en lugar de prevenir o tratar enfermedades. La sociedad debe decidir dónde establecer los límites.
En el caso de la terapia celular, las principales preocupaciones éticas giran en torno a la seguridad y el fraude. Dado que las terapias con células madre tienen un gran potencial, algunas clínicas ofrecen tratamientos no comprobados directamente a los pacientes sin pasar por ensayos clínicos adecuados. La Sociedad Estadounidense de Terapia Génica y Celular (ASGCT) advierte que “algunos proveedores poco éticos… ofrecen productos de terapia celular que no han sido probados para verificar si funcionan y que podrían ser peligrosos”. Esto ha provocado daños en pacientes en algunos casos. Las terapias celulares legítimas deben pasar por ensayos clínicos rigurosos y una revisión regulatoria. Se aconseja a los pacientes tener precaución con las “clínicas de células madre” que prometen curas milagrosas.
Ambos campos también enfrentan cuestiones de justicia y acceso. Si estas terapias avanzadas siguen siendo extremadamente costosas, ¿solo se beneficiarán las personas adineradas? ¿Las cubrirán los seguros? Además, estos tratamientos podrían llevar a una menor aceptación social de las personas con condiciones genéticas, si se empieza a esperar que todos tengan “genes perfectos”.
En resumen, las terapias génica y celular aportan una enorme esperanza, pero también requieren una supervisión ética rigurosa. Los diálogos continuos entre científicos, expertos en bioética y la sociedad buscan garantizar que estas tecnologías se utilicen de manera segura y justa.
Conclusión: Una nueva era de la medicina impulsada por la biotecnología
La terapia celular y la terapia génica representan dos de los avances más prometedores de la medicina moderna. Al tratar las enfermedades desde su raíz, ya sea restaurando tejidos dañados o corrigiendo instrucciones genéticas defectuosas, estas terapias están transformando la forma en que abordamos el cáncer, los trastornos raros y la medicina regenerativa. Aunque cada una tiene mecanismos, riesgos y aplicaciones específicas, ambas comparten el potencial de ofrecer resultados duraderos y transformadores allí donde los tratamientos tradicionales no alcanzan.
A medida que el campo avanza, la integración de bioprocesos avanzados, automatización y tecnologías de un solo uso se vuelve cada vez más esencial. Aquí es donde TECNIC desempeña un papel fundamental. Con presencia global y un portafolio que incluye biorreactores modulares, plataformas de perfusión, sistemas TFF y flowkits y bolsas de un solo uso, TECNIC proporciona la infraestructura necesaria para un desarrollo seguro, escalable y eficiente de terapias celulares y génicas.
Desde la investigación en etapas tempranas hasta la producción a escala comercial, TECNIC apoya a empresas biofarmacéuticas e instituciones de investigación en llevar terapias que cambian vidas a los pacientes, de forma más rápida, segura y con un control total del proceso.

Frequently Asked Questions (FAQ)
Gene therapy modifies genetic material to treat or prevent disease, while cell therapy uses living cells to repair or replace damaged tissues or cells.
Not exactly. Stem cell therapies are a type of cell therapy, while gene therapy involves genetic modification. Some treatments combine both approaches.
Gene therapy is a medical treatment that involves modifying or replacing faulty genes inside the body’s cells to treat or prevent diseases, especially genetic disorders.
Cell therapy is a technique where live, healthy cells are introduced into a patient’s body to repair or replace damaged tissue, regenerate function, or strengthen the immune system.
They are generally safe under medical supervision, but like all treatments, they carry risks depending on the method, patient condition, and regulatory oversight.
Cell therapy is used for cancers (like CAR-T), immune disorders, orthopedic injuries, and degenerative diseases, among others.
Gene addition, gene editing (e.g., CRISPR), and gene silencing are common types of gene therapy used to treat genetic disorders and cancers.
Referencias
American Society of Gene & Cell Therapy. (n.d.). Gene Therapy Basics.
American Society of Gene & Cell Therapy. (n.d.). Cell Therapy Basics.
National Human Genome Research Institute. (2022). What are the Ethical Concerns of Genome Editing?
U.S. Food and Drug Administration. (n.d.). Approved Cellular and Gene Therapy Products.
International Society for Stem Cell Research. (n.d.). The ISSCR Guide to Stem Cell Treatments.
Nature Biotechnology. (2023). CRISPR-Cas 9 genome.
ScienceDirect. (2021). Cell and gene therapy investment.









